Résistance aux antibiotiques : la problématique
La résistance aux antibiotiques, qu'est-ce que c'est ?
La résistance aux antibiotiques - ou antibiorésistance - est définie par l’inefficacité du traitement antibiotique sur l’infection bactérienne ciblée.
L'administration répétée d'antibiotiques chez l'homme ou l'animal est responsable de l’augmentation des résistances bactériennes aux antibiotiques : la présence d’antibiotique dans l’organisme favorise la sélection des bactéries qui sont résistantes, soit naturellement, soit par mutation ou soit par des échanges de matériel génétique (plasmide) avec d’autres bactéries. Les antibiotiques absorbés vont éliminer les bactéries sensibles pour laisser place aux bactéries résistantes. Celles-ci peuvent se transmettre et diffuser entre les individus, particulièrement en milieu de soins. Elles rendent les traitements antibiotiques ultérieurs moins efficaces pour le patient et pour la collectivité.

La résistance aux antibiotiques s’est progressivement développée et concerne aujourd’hui l’ensemble des bactéries pathogènes. Elle résulte de l'administration répétée d'antibiotiques chez l'homme ou l'animal qui crée des conditions, appelées « une pression de sélection » favorisant l’acquisition et la dissémination de souches résistantes aux antibiotiques. Aujourd’hui, les nouvelles molécules sont rares et il n’est parfois plus possible difficile, voire impossible de traiter certaines infections.

La résistance aux antibiotiques résulte soit de mutations chromosomiques (modification de gènes déjà présents), soit de l’intégration de petits brins d’ADN circulaires qui se transmettent de bactérie à bactérie (les plasmides). Les résistances chromosomiques ne concernent qu’un antibiotique ou une famille d’antibiotiques à la fois. Les résistances plasmidiques sont les plus répandues (80 % des résistances acquises) et peuvent concerner plusieurs antibiotiques, voire plusieurs familles d’antibiotiques. On parle alors de multirésistance. Le transfert de mécanismes de résistance peut intervenir d’une souche à l’autre ou d’une espèce à l’autre. L’accumulation de mécanismes de résistance chez une même souche bactérienne, peut conduire à des impasses thérapeutiques. Les mécanismes de résistance sont nombreux : production d’une enzyme détruisant l’antibiotique, imperméabilisation de la membrane de la bactérie, modification de la cible de l’antibiotique…

La résistance aux antibiotiques, à quoi c’est dû ?
Un usage inadapté des antibiotiques
Les antibiotiques ne sont efficaces que sur les infections bactériennes. Ils sont encore trop souvent prescrits pour des infections virales comme la grippe. L'administration répétée d'antibiotiques chez l'homme ou l'animal est responsable de l’augmentation des résistances bactériennes aux antibiotiques en créant ce qu'on appelle une "pression de sélection" : le niveau d’antibiotique dans l’organisme atteint favorise les mutations et les échanges plasmidiques responsables d’acquisition de résistances aux antibiotiques. Ce phénomène tend à éliminer les bactéries sensibles pour laisser place aux bactéries résistantes. Plus on prend d’antibiotiques, plus le risque de faire émerger des bactéries résistantes s’accroît. Ces dernières rendent les traitements antibiotiques ultérieurs moins efficaces pour le patient et pour la collectivité.
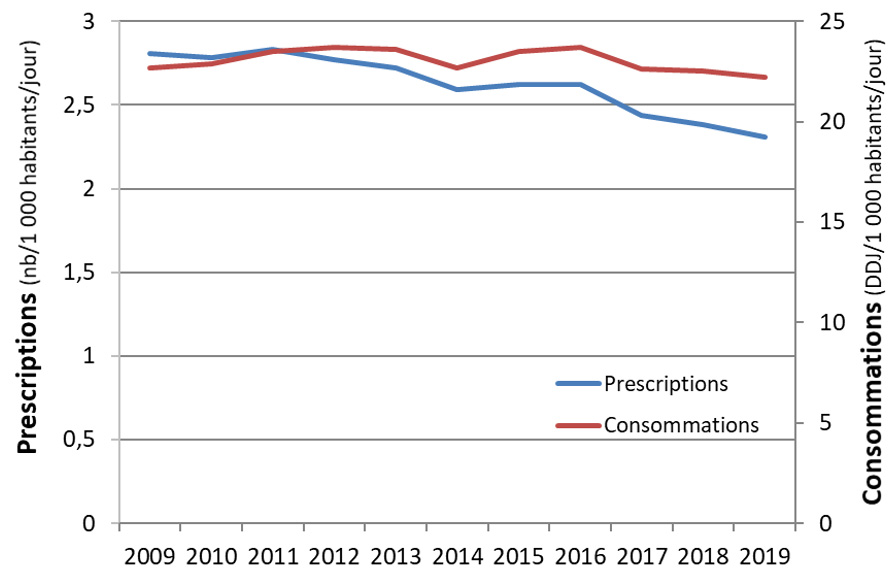
La consommation d’antibiotiques en santé humaine en France
La place des bactéries résistantes apparaît être réversible lorsque la pression de sélection diminue. Ainsi depuis 2016, alors que la consommation globale d’antibiotiques marque une diminution, la résistance aux céphalosporines de 3e génération chez E. coli amorce une diminution après 10 ans d’augmentation constante.
Néanmoins, la consommation d’antibiotiques en France demeure en 2019 environ 30% supérieure à la consommation globale moyenne en Europe, imposant de poursuivre les efforts engagés pour un meilleur usage des antibiotiques.
Après 10 années d’augmentation constante et importante, la résistance aux céphalosporines de 3e génération chez Escherichia coli semble amorcer une diminution, en ville, en établissements pour personnes âgées dépendantes comme en établissements de santé depuis 2016.

Comment lutter contre la résistance aux antibiotiques ?
La maîtrise de la résistance aux antibiotiques passe par : une meilleure utilisation des antibiotiques pour réduire la pression de sélection et par des mesures d’hygiène pour limiter la transmission bactérienne.
Une meilleure utilisation
Pour que les antibiotiques restent efficaces, c’est-à-dire pour limiter l’apparition de bactéries résistantes, quelques principes d’utilisation sont de mise : la bonne molécule, à la bonne dose, et pour la bonne durée. Il existe également des tests de diagnostic rapides qui permettent d'aider au diagnostic d'une infection bactérienne et éviter des traitements antibiotiques inutiles (si les tests diagnostiques sont négatifs).
Le bon usage des antibiotiques, c’est la bonne indication, la bonne molécule, la bonne dose et la bonne durée de traitement.

Des mesures de prévention de la transmission
La prévention des infections est le 1er pilier de la lutte contre l’antibiorésistance. En effet, tout traitement antibiotique comporte un risque de résistance bactérienne.
Hygiène des mains et respect des précautions d’hygiène sont les principales mesures pour limiter la transmission des bactéries résistantes, comme non résistantes.

Bien que les antibiotiques ne soient pas efficaces sur les virus, es infections virales respiratoires sont l’objet de nombreuses prescriptions d’antibiotiques, soit par difficulté de diagnostic différentiel avec des infections bactériennes respiratoires, soit par crainte de complications par surinfections bactériennes (pourtant rares), en particulier chez les jeunes enfants ou les personnes âgées. Ainsi, chaque infection virale évitée est une tentation de prescription d’antibiotiques de moins.
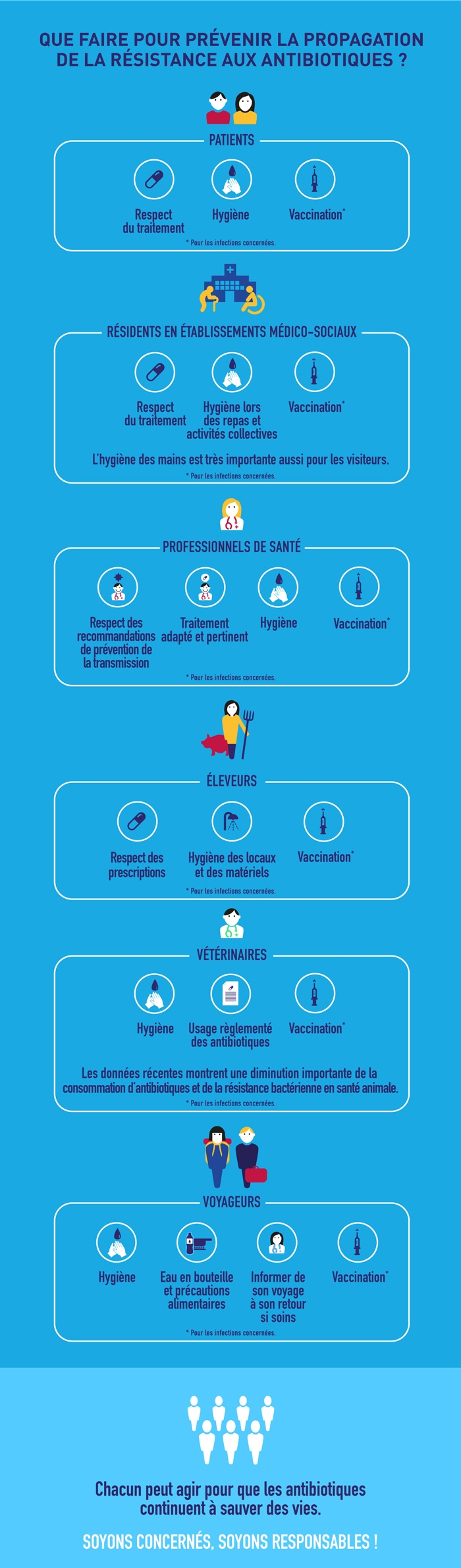
Par ailleurs, il est important de mieux connaitre leur mode de transmission pour mieux les prévenir.

L’antibiorésistance est une menace mondiale aux conséquences individuelles
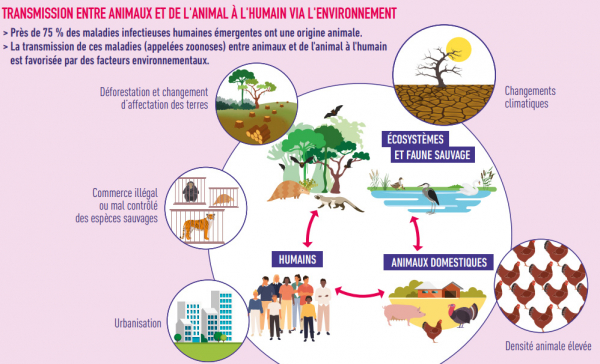
L'antibiorésistance concerne les humains, mais également les animaux et l'environnement qui sont interconnectés et forment un tout. La lutte contre l’antibiorésistance nécessite donc une action globale « une seule santé ».
L’antibiorésistance menace l’ensemble du vivant, partout dans le monde
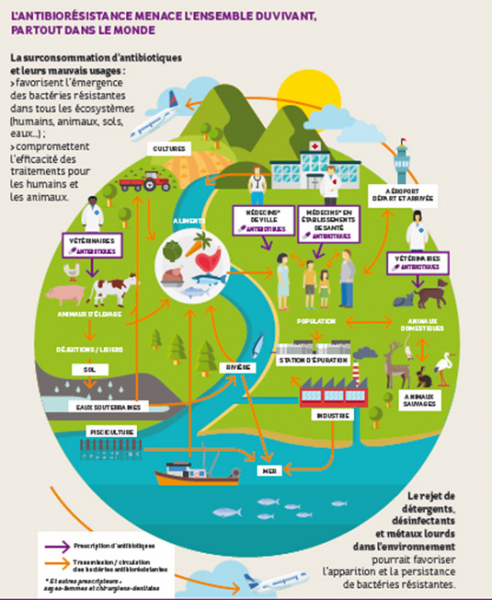
Santé humaine, santé animale et santé des écosystèmes sont étroitement liés pour préserver l’efficacité des antibiotiques
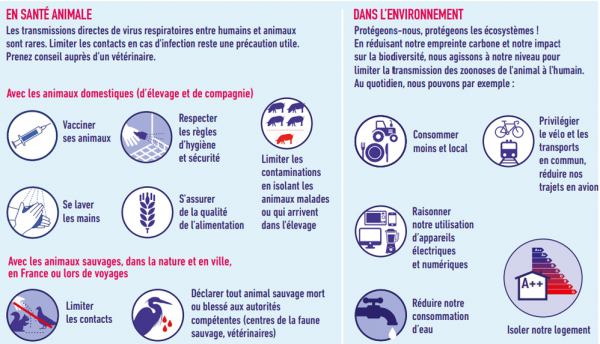
La lutte contre l’antibiorésistance implique la prévention des infections par des mesures d’hygiène (l’hygiène des mains au premier plan), la vaccination et un usage raisonné des antibiotiques en santé humaine et animale.
« Des conséquences individuelles »
Aujourd’hui, certaines résistances bactériennes peuvent compliquer le traitement d’une infection, même initialement bénignes. Tout le monde (humain comme animaux) peut un jour ou l’autre être infecté par une bactérie multirésistante aux antibiotiques, quel que soit son état de santé et ses facteurs de risque.
Dans cette situation, l’arsenal thérapeutique est réduit induisant un retard à la mise en œuvre du meilleur traitement ; le délai de guérison peut s’en trouver allongé, avec un risque accru de complications et de mortalité pour les infections les plus graves. Les antibiotiques qui sont encore actifs sur la bactérie multirésistante sont des antibiotiques de deuxième intention, selon les recommandations existantes, et comportent parfois un risque plus élevé d’effets indésirables.
Enfin, en santé humaine, ces antibiotiques de deuxième intention ne sont souvent disponibles que par voie injectable, certains uniquement à l’hôpital, ce qui complique la prise en charge, réduit la qualité de vie des patients et comporte des risques d’infections nosocomiales. Les cas d’infections à bactéries résistantes à tous les antibiotiques restent, à ce jour, heureusement exceptionnelles en France.


